dalla American Institute of Physics
La pandemia COVID-19 ha chiarito che le innovazioni tecnologiche erano urgentemente necessarie per rilevare, trattare e prevenire il virus SARS-CoV-2. A un anno e mezzo dall’inizio di questa epidemia, continuano ad esistere ondate di epidemie successive e il disperato bisogno di nuove soluzioni mediche, in particolare i test.
Nel Journal of Vacuum Science & Technology B , i ricercatori dell’Università della Florida e della National Chiao Tung University di Taiwan riportano un metodo di test rapido e sensibile per i biomarcatori COVID-19.
I ricercatori, che in precedenza hanno dimostrato il rilevamento di biomarcatori rilevanti in epidemie ed emergenze, come il virus Zika, attacchi di cuore e perdite di liquido spinale cerebrale, hanno sfruttato la loro esperienza per sviluppare un sistema di sensori che fornisce il rilevamento entro un secondo, che è molto più veloce di attuali metodi di rilevamento COVID-19.
“Questo potrebbe alleviare i problemi di tempi di consegna dei test COVID-19 lenti”, ha detto Minghan Xian, autore e dottorando in ingegneria chimica presso l’Università della Florida.
Il rilevamento della presenza del virus richiede l’amplificazione del numero del biomarcatore, come le copie di acido ribonucleico virale nella tecnica di reazione a catena della polimerasi comune per il rilevamento di COVID-19, o l’amplificazione del segnale di legame per un biomarcatore bersaglio. Il metodo del gruppo amplifica il segnale di legame per un biomarcatore bersaglio.
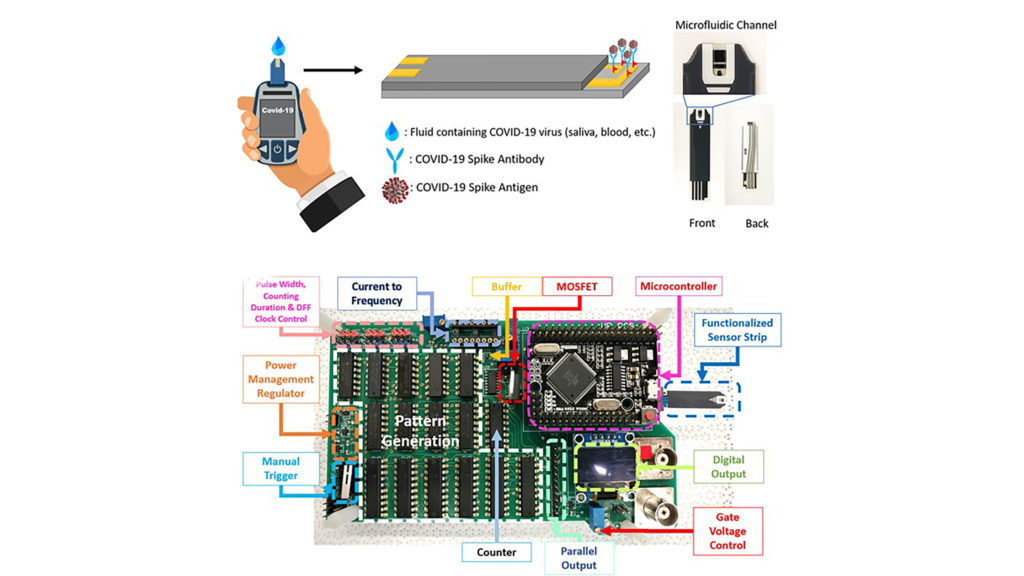
“La nostra striscia biosensore è simile alle strisce reattive per il glucosio disponibili in commercio nella forma, con un piccolo canale microfluidico sulla punta per introdurre il nostro fluido di prova”, ha detto Xian. “All’interno del canale microfluidico, alcuni elettrodi sono esposti al fluido. Uno è rivestito d’oro e gli anticorpi rilevanti per COVID sono attaccati alla superficie dell’oro tramite un metodo chimico”.
Durante la misurazione, le strisce del sensore sono collegate a un circuito stampato tramite un connettore e un breve segnale di test elettrico viene inviato tra l’elettrodo d’oro legato con l’anticorpo COVID e un altro elettrodo ausiliario. Questo segnale viene quindi restituito al circuito stampato per l’analisi.
“Il nostro sistema di sensori, un circuito stampato, utilizza un transistor per amplificare il segnale elettrico, che poi viene convertito in un numero sullo schermo”, ha detto Xian. “L’entità di questo numero dipende dalla concentrazione dell’antigene, la proteina virale, presente nella nostra soluzione di prova”.
Sebbene le strisce del sensore del sistema debbano chiaramente essere eliminate dopo l’uso, la scheda del circuito di test è riutilizzabile. Ciò significa che il costo del test può essere notevolmente ridotto. La versatilità di questa tecnologia va ben oltre il rilevamento di COIVD-19.
“Alterando il tipo di anticorpi attaccati alla superficie d’oro, possiamo riutilizzare il sistema per rilevare altre malattie”, ha detto Xian. “Il sistema può fungere da prototipo per sensori di biomarcatori proteici modulari ed economici per un utile feedback in tempo reale all’interno di applicazioni cliniche, sale operatorie o uso domestico”.
Abstract : Journal of Vacuum Science & Technology
Rilevamento rapido del virus SARS-CoV-2 utilizzando cartucce monouso e una piattaforma biosensoriale basata su semiconduttori
Il rilevamento della proteina spike SARS-CoV-2 e del virus inattivato è stato ottenuto utilizzando strisce funzionali monouso e biofunzionalizzate, che possono essere collegate esternamente a un circuito stampato riutilizzabile per l’amplificazione del segnale con un transistor a effetto di campo semiconduttore (MOSFET) incorporato ). È stata eseguita una serie di reazioni chimiche per immobilizzare sia un anticorpo monoclonale che un anticorpo policlonale sull’elettrodo rivestito con Au utilizzato come superficie di rilevamento. Un passo importante nella biofunzionalizzazione, vale a dire, la formazione di cluster placcati in Au sulle strisce del sensore, è stata verificata mediante microscopia elettronica a scansione, nonché misurazioni elettriche, per confermare il successo del legame dei gruppi tiolici su questa superficie Au. Il sensore funzionalizzato è stato collegato esternamente all’elettrodo di gate del MOSFET, e impulsi sincroni sono stati applicati sia alla striscia di rilevamento che al contatto di drenaggio del MOSFET. I cambiamenti risultanti nella dinamica delle forme d’onda di drenaggio sono stati convertiti in tensioni analogiche e letture digitali, che sono correlate alla concentrazione di proteine e virus presenti nella soluzione testata. Una vasta gamma di concentrazioni di proteine da 1 fg / ml a 10 μ g / ml e concentrazioni di virus da 100 a 2500 PFU / ml erano rilevabili per il sensore funzionalizzato con entrambi gli anticorpi. I risultati mostrano il potenziale di questo approccio per lo sviluppo di un sistema di sensori a cartuccia portatile, a basso costo e usa e getta per il rilevamento point-of-care delle malattie virali.
INTRODUZIONE
Lo scoppio del virus altamente infettivo SARS-CoV-2 (COVID-19) ha portato a una pandemia globale, principalmente attraverso la diffusione di goccioline respiratorie durante le riunioni di persona. Le pratiche di salute pubblica come la quarantena domestica, l’allontanamento sociale, la disinfezione e l’uso di dispositivi di protezione individuale (DPI) rimangono i principali approcci preventivi. 1Secondo l’Organizzazione Mondiale della Sanità (OMS), a partire da fine marzo 2021, ci sono stati oltre 125 × 10 6 casi confermati a livello globale, con oltre 2,7 × 10 6 morti. 2Sebbene la vaccinazione su vasta scala e la ricerca su potenziali terapie siano in corso, sono ancora necessari test rapidi e diagnosi per COVID-19 per una ripresa sicura dell’attività quotidiana. Attualmente, ci sono due metodi principali di rilevamento per la diagnosi di COVID-19. Il metodo della reazione a catena della polimerasi di trascrizione inversa (RT-PCR) è il test diretto più utilizzato per la presenza del virus SARS-CoV-2, con test anticorpali usati come strumento supplementare. I test sierologici richiedono tempi più lunghi rispetto alla PCR; tuttavia, secondo Marca et al , test come i saggi di immunoassorbimento enzimatico (ELISA) e la chemiluminescenza sono in grado di scalare fino a un elevato rendimento e portare a una riduzione dei costi e del tempo dal test al risultato . La proteina a spillo è cruciale per il legame e la fusione del virus, dove la proteina S1 è responsabile del legame, mentre la proteina S2 è responsabile della fusione. Sono state inoltre stabilite numerose tecnologie di rilevamento basate sul dominio di legame del recettore delle proteine S per i coronavirus umani.
Oltre alla raccolta tramite tamponi orofaringei e nasofaringei convenzionali, SARS-CoV-2 è stato rilevato anche nella saliva umana, il che indica che questo può contribuire come via di trasmissione, ma fornisce anche un’opportunità per il test del virus con un metodo non invasivo e facile di collezione. Infatti, Wyllie et al . ha confrontato i campioni di saliva e rinofaringei corrispondenti al paziente e ha concluso che i test della saliva producono un maggiore rilevamento del titolo, una ridotta variabilità e una migliore consistenza nella RT-PCR. Inoltre, il metodo di auto-raccolta non è invasivo e riduce al minimo l’interazione tra il paziente e gli operatori sanitari senza richiedere alcun mezzo di trasporto specializzato. Queste caratteristiche interessanti rendono la saliva una piattaforma attraente per l’adattamento negli strumenti diagnostici.
I sistemi di biosensori a base elettrochimica sono un esempio di test sierologici per COVID-19 che utilizza la formazione di un complesso antigene-anticorpo su una superficie di rilevamento per eseguire la diagnosi. Alcuni di questi sensori sono stati precedentemente dimostrati utilizzando vari materiali di costruzione e tecnologie di rilevamento. Seo et al . ha utilizzato transistor a effetto di campo (FET) a base di grafene per dimostrare il rilevamento della proteina spike in virus coltivati e campioni clinici per SARS-CoV-2. Un rilevatore basato sull’impedenza elettrochimica per l’anticorpo SARS-CoV-2 è stato dimostrato da Rashed et al ., mentre Alafeef et al . hanno funzionalizzato con successo oligonucleotidi antisenso sulle superfici dei sensori per il rilevamento delle proteine nucleocapsidiche.
Indipendentemente dall’obiettivo per il rilevamento e dal materiale di costruzione, il costo di produzione / collaudo e la facilità di trasporto sono fondamentali per la commercializzazione di successo di un sistema di sensori. Analogamente a molte altre tecnologie di transistor, i transistor AlGaN / GaN ad alta mobilità elettronica (HEMT) sono stati ampiamente studiati per la rilevazione di varie sostanze chimiche e biomarcatori; tuttavia, il gate di questi transistor è esposto come superficie di rilevamento, il che rende proibitivo il costo della sostituzione del sensore per un uso su larga scala. Un approccio molto meno costoso è il rilevamento del biomarcatore utilizzando un sensore monouso fabbricato su vetrini. Questo è stato utilizzato in precedenza per rilevare il liquido cerebrospinale (CSF), la troponina cardiaca I e il virus Zika, utilizzando una tensione di polarizzazione sincrona a doppio impulso sia sul gate che sul drain del transistor e un MOSFET esternalizzato.
In questo lavoro, viene dimostrato un sistema biosensore modulare costituito da un Si-MOSFET con una lettura digitale incorporata, in combinazione con strisce sensore a cartuccia esternalizzate, per il rilevamento rapido della proteina COVID-19 S e del virus inattivato dall’uomo in una piattaforma di saliva.
MATERIALE E METODO
Le strisce reattive per il glucosio disponibili in commercio sono state utilizzate come cartucce biofunzionalizzate per le misurazioni elettrochimiche. Lo schema generale del sistema è mostrato in figura in alto . Gli elettrodi di carbonio all’interno del canale microfluidico della striscia reattiva sono stati placcati in oro utilizzando una soluzione di placcatura in oro e biofunzionalizzati con anticorpi SARS-CoV-2; nel frattempo, l’elettrodo centrale è stato collegato elettricamente all’elettrodo di gate del MOSFET (Texas Instruments SN74S124N). Gli elettrodi placcati in Au all’interno del canale microfluidico sono stati prima trattati con 10 mM di acido tioglicolico (TGA) in etanolo per 4 ore. La formazione del legame Au – S è stata verificata mediante misurazione elettrica e spettroscopia fotoelettronica a raggi X, come fatto nel lavoro precedente. Per convalidare la corretta formazione del legame Au – S utilizzando un tale metodo, la misurazione elettrica è stata effettuata utilizzando un analizzatore di parametri Agilent 4156C per misurare la corrente tra un elettrodo di carbonio placcato Au trattato con etanetiolo (EtSH) e un elettrodo di carbone ausiliario non placcato. È stato osservato che la corrente diminuisce in modo significativo con l’aumento del tempo di trattamento e della concentrazione di EtSH, indicando la copertura della superficie da parte dello strato funzionale.
Successivamente, una reazione chimica in due fasi è stata utilizzata per migliorare il legame dell’anticorpo immergendo l’elettrodo funzionalizzato TGA in N, N’-dicicloesilcarbodiimmide (0,1 mM) in acetonitrile per 30 min e N-idrossisuccinimide (0,1 mM) in acetonitrile per un’ora. Il reagente in eccesso è stato risciacquato con acetonitrile e wafer DI dopo la reazione. Per funzionalizzare le strisce reattive sono stati utilizzati due diversi tipi di anticorpi SARS-CoV-2 (COVID-19), l’anticorpo monoclonale MCA-5G8 (EnCor Biotechnology) e l’anticorpo spike policlonale (Prosci # 3535). 20 μg / ml di soluzione anticorpale in soluzione tampone fosfato (PBS) è stato introdotto sulla superficie dell’elettrodo ed è stato incubato per 18 ore a 4 ° C. Quindi, le strisce reattive sono state risciacquate con PBS e conservate in frigorifero a 4 ° C prima dell’uso. Sia il peptide spike SARS-CoV-2 (Prosci 3525P) che il virus inattivato (ATCC VR-1986HK) sono stati diluiti in serie nella saliva e conservati a 4 ° C prima dell’uso.
Una scheda a circuito stampato (PCB), è stato progettato per inviare un segnale di impulso di tensione sincrono agli elettrodi di gate e di drain del MOSFET, utilizzando il metodo del doppio impulso sviluppato in precedenza. La durata dell’impulso di drenaggio (onda quadra a V DD ) è stata di circa 1,1 ms a tensione costante, mentre l’impulso di gate è iniziato a circa 40 μ s dopo l’inizio del segnale dell’impulso di drenaggio e si è fermato a 40 μ s prima della fine del drenaggio impulso. Un resistore da 13 kΩ è stato collegato allo scarico come un resistore di carico. Il circuito stampato è stato in grado di generare segnali a impulsi e convertire l’uscita di drain analogico del MOSFET in un’uscita digitale a quattro cifre dopo ogni trigger di impulso. Forma d’onda analogica scarico (V D ) sono stati raccolti con un oscilloscopio Agilent InfiniiVision DSO7054B, e la lettura della tensione a 750 μ s è stato estratto come valore analogico. Un oscillatore controllato in tensione (SN74S124 N) è stato utilizzato per convertire la forma d’onda di drain in un’uscita di frequenza, ed è stato successivamente integrato utilizzando un microcontrollore Arduino incorporato per tradurre in un segnale digitale a quattro cifre, mostrato in . Uno schermo LCD integrato è stato utilizzato per visualizzare il risultato. Otto segnali di impulso sono stati raccolti e mediati per ciascuna concentrazione di campionamento per il segnale analogico e la lettura digitale.
RISULTATO E DISCUSSIONE
Per preparare una superficie di rilevamento immobilizzata con l’anticorpo appropriato di scelta per la misurazione elettrica, è necessaria una superficie metallica realizzata con Au o Ag per avviare la sequenza della chimica di reazione per la biofunzionalizzazione della superficie. Le immagini SEM, mostrano l’evoluzione dipendente dal tempo della copertura dei grappoli d’oro placcati sugli elettrodi di carbonio. Un rapido inizio di nucleazione si verifica entro il primo minuto dalla placcatura e la dimensione delle particelle continua a crescere e formare agglomerati durante il resto del processo. La crescita delle particelle produce picchi e frammenti su questa superficie del cluster, ma non si osserva alcuna ulteriore nucleazione delle particelle dopo 1,5 min. Per aumentare ulteriormente la superficie, in futuro si potrà prendere in considerazione la funzionalizzazione utilizzando particelle di Au su scala nanometrica invece della galvanica.

Immagini SEM di grappoli d’oro formati su una superficie di grafite all’interno di un canale microfluidico in tempi di placcatura differenti.